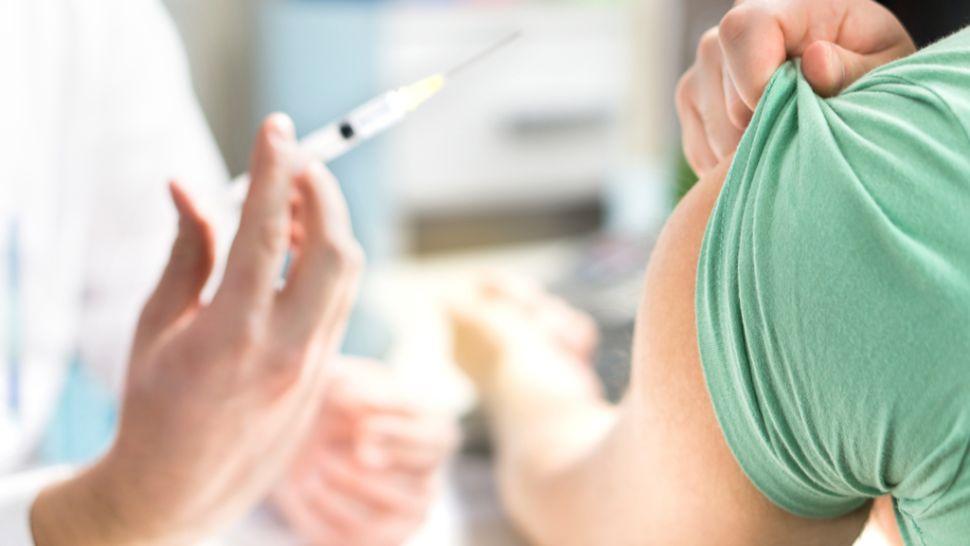
تُعرف تجربة لقاح وباء كورونا التي تم إطلاقها مؤخراً، باسم «المرحلة الأولى من التجارب السريرية» «Phase 1 clinical trial»، ما يعني أن الغرض الرئيسي منها هو توفير معلومات حول كيفية تفاعل اللقاح مع جسم بشري سليم، وفقاً لإدارة الغذاء والدواء الأميركية (FDA).
تفحص تجارب المرحلة الأولى مجموعة صغيرة من الأشخاص، تتراوح عادة بين 20 و80 شخصاً، يتلقون جرعات مختلفة من العلاج التجريبي. على مدار عدة أشهر، يراقب الباحثون كيفية استقبال كل متطوع للعلاج المحدد وما هي الآثار الجانبية الشائعة التي تظهر استجابة لجرعات مختلفة؟
سيتلقى في هذه التجربة الجديدة 45 متطوعاً جرعات مختلفة من اللقاح الجديد، يسمى mRNA - 1273، وسيتم مراقبتها على مدى 14 شهراً.
سيتم حقن المتطوعين حقنتين من اللقاح في الجزء العلوي من الذراع، مع فجوة مدتها 28 يوماً بين الجرعات.
سيحصل المشارك الأول على أقل جرعة من اللقاح، أي 25 ميكروغراماً (مكغ) لكل حقنة، وفقاً لبيان NIAID، فيما سيحصل ثلاثة آخرون على نفس الجرعة الأولية، وسيحقن الأربعة الآخرون بجرعة 100 ميكروغرام من اللقاح، وسيتم تقييمها بدقة قبل إعطاء أي متطوع جرعتهم الثانية.
وإذا ثبت أن ردود فعل المشاركين تجاه الجرعات المنخفضة مقبولة، ستتلقى مجموعة ثالثة من المشاركين 250 ميكروغراماً من اللقاح لكل حقنة.
بالإضافة إلى مراقبة الآثار الجانبية، سيختبر الباحثون ما إذا كان اللقاح يؤدي إلى استجابة مناعية عن طريق تحليل دم المتطوعين بحثاً عن أجسام مضادة، وفقاً لـClinicalTrials. gov.
إذا كان اللقاح يعمل على النحو المتوقع، فيجب أن يولد الجهاز المناعي أجساماً مضادة تمسك ببروتين مميز موجود على سطح الفيروس التاجي الجديد SARS - CoV - 2. وفقاً لتقرير صادر عن Kaiser Permanente، شركة الرعاية الصحية التي تجري التجربة.
وبدلاً من إدخال فيروس ميت أو ضعيف في الجسم لتحفيز هذا التفاعل، كما تفعل اللقاحات التقليدية، يرشد اللقاح الخلايا لبناء البروتين الفيروسي نفسها باستخدام جزيء يسمى messenger RNA (mRNA). بمجرد استخدامه من قبل الجسم، يجب أن ينكسر mRNA ويتم التخلص منه، تاركاً فقط مضاداً وقائياً.
إثبات نجاح عمل اللقاح
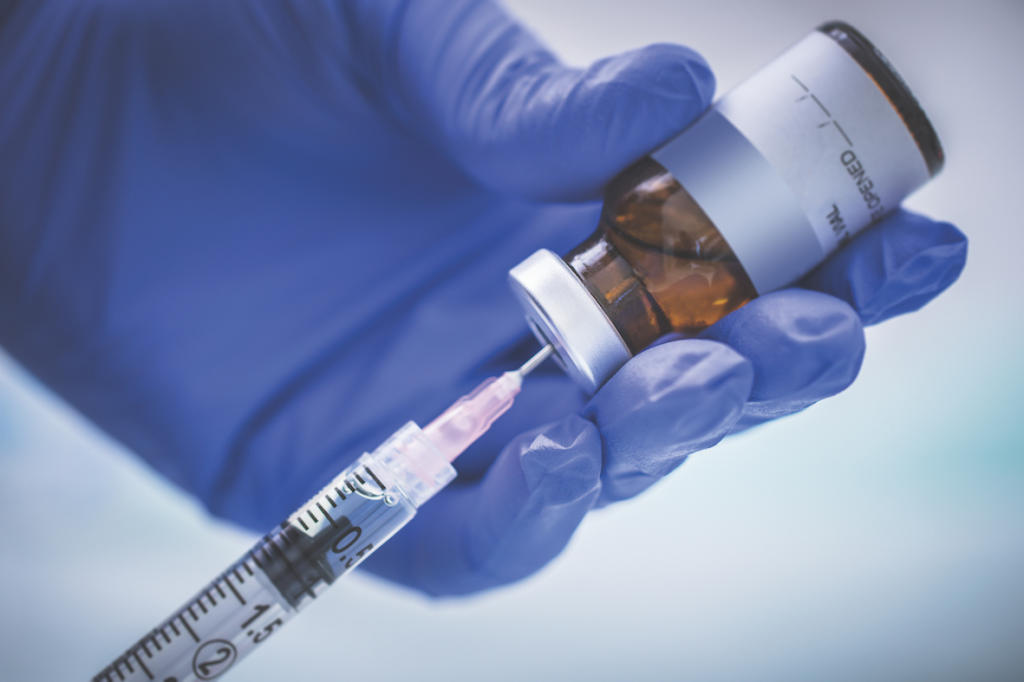
بعد تجربة المرحلة الأولى من اللقاح التجريبي، يجب بعد ذلك اختبار الدواء في مجموعات أكبر من الأشخاص وعلى مدى فترات زمنية أطول، في تجارب المرحلة 2 والمرحلة 3. وفقاً للمراكز الأميركية لمكافحة الأمراض والوقاية منها (CDC).
تفحص تجارب المرحلة الثانية عادة عدة مئات من الأشخاص وتراقب المشاركين لفترات تتراوح من عدة أشهر إلى سنتين. بشكل أساسي، تعمل تجارب المرحلة الثانية كمقياس ثانوي للأمان وتساعد الباحثين على تحسين جرعات دواء معين.
في هذه المرحلة، يختار الباحثون المشاركين ذوي خصائص معينة، مثل العمر والصحة البدنية، تتطابق مع خصائص الأشخاص الذين يتم تطوير اللقاح من أجلهم، (على سبيل المثال، رغم أن أي شخص يمكن أن يصاب بـCOVID - 19. فإن الأشخاص في سن متقدمة والذين يعانون من حالات مزمنة هم أكثر عرضة للإصابة بأعراض حادة، لذلك يمكن أن يكون هذا في الاعتبار في تجارب المرحلة الثانية.)
عادة ما تتبع تجارب المرحلة الثالثة 300 إلى 3000 متطوع على مدار سنة إلى أربع سنوات، وفقاً لإدارة الغذاء والدواء FDA، مع مجموعة أكبر من الناس، يمكن للباحثين ملاحظة الآثار الجانبية غير المعتادة للدواء.
وبإطالة فترة الدراسة، يمكنهم التقاط آثار جانبية طويلة المدى عند ظهورها. يجب أن تثبت تجارب المرحلة الثالثة أن دواء معيناً يوفر الفوائد الطبية التي صنع لأجلها؛ ما يعني أنه إذا اجتاز لقاح الفيروس التاجي هذا الاختبار، يمكن أن توافق إدارة الغذاء والدواء على الدواء للاستخدام على نطاق واسع.
بعد موافقة إدارة الغذاء والدواء الأميركية (FDA)، تخضع الأدوية للتجارب السريرية للمرحلة الرابعة، والمعروفة باسم «تجارب مراقبة ما بعد التسويق». بمجرد دخول الدواء للاستخدام العام، يراقب الباحثون عدة آلاف من المتطوعين لتحديد الآثار الجانبية التي لم تظهر في التجارب السابقة وتتبع مدى عمل اللقاح على مدى فترات طويلة من الزمن، وفقاً للمعهد الوطني للسرطان.
قد يصل أو لا يصل لقاح الفيروس التاجي هذا إلى تجارب المرحلة الرابعة في السنوات القادمة، رغم أن الدراسات المحدودة على الفئران حتى الآن أظهرت نتائج واعدة. في غضون ذلك، ستواصل المجموعات البحثية حول العالم تطوير لقاحات بديلة لمكافحة انتشار COVID - 19. وفقاً لوكالة أسوشيتد برس.
المصدر: موقع لايف ساينس